《神经科学杂志》研究结果显示,高脂饮食会诱发神经细胞的髓鞘损伤,而NMN可抵抗这种损伤,恢复其再生能力

2021年,一部疾病题材的电影《了不起的老爸》热映,讲述的是因患多发性硬化症而视力障碍的男主角肖尔东在父亲的引导下奋力完成马拉松比赛的故事(图1)。影片不仅传达了主人公不屈服命运的精神内涵,还将“多发性硬化症”这一罕见的神经系统疾病带入了大众视野。

多发性硬化症是一种最常见的中枢神经系统脱髓鞘病,常发生语言、视力、精神障碍,及肢体麻痹至瘫痪等情况,因其致残率高且高发于青壮年,也被称之为“不死癌症”。研究表明[1],肥胖是多发性硬化症的一个关键风险因素,其会导致脑白质异常和中枢神经系统少突胶质细胞的丢失。因此,与肥胖相关的高脂饮食或缺乏运动均可能是损伤髓鞘,诱发多发性硬化症的不利因素,但具体作用机制仍尚待研究。
来自美国梅奥诊所(Mayo Clinic)的Langley等人的研究对可能的机制提出了新思路,即摄入高脂饮食会引发代谢紊乱,升高一种名为“CD38”的蛋白(NAD+消耗酶)含量而消耗烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+),导致星形胶质细胞活化,少突神经胶质细胞病变,从而损害髓鞘再生,但NAD+前体烟酰胺单核苷酸(NMN)可有效逆转上述不利影响。目前该研究已发表在《神经科学杂志》(Journal of Neuroscience)[2]上。

高脂饮食、NAD+与多发性硬化症的相关性
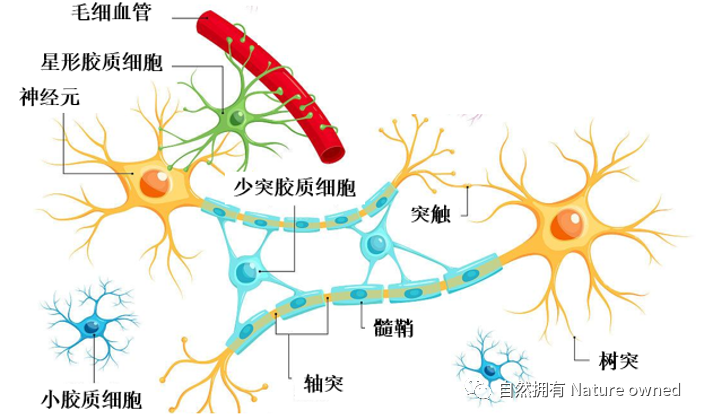
高脂饮食会破坏一种被称为“少突胶质”的髓鞘细胞和另一种被称为“星形胶质”的神经细胞,这两种细胞均分布于中枢神经系统。
星形胶质细胞是体积最大、数量最多、功能最复杂的神经胶质细胞。主要发挥支持和分隔神经细胞的作用,并参与血脑屏障,对递质代谢、信号传递具有重要作用;少突胶质细胞在脑白质中,并排存在于有髓神经纤维之间,构成髓鞘,主要协助信号传递和维护神经元功能,这两种神经细胞功能异常可能会导致中枢神经系统脱髓鞘病变、神经元损伤或精神类等疾病(图3)。
NAD+是维持细胞能量的关键物质,参与多种代谢过程,包括脂肪代谢。而已有研究表明[3],CD38是神经细胞中NAD+的主要消耗酶,其水平在多发性硬化症和高脂饮食摄入后均显著升高。因此,Langley等人在此基础上继续深入探究了NAD+、CD38、高脂饮食与多发性硬化症等脱髓鞘类疾病之间的关系。
高脂饮食可增加神经细胞中CD38含量,降低NAD+水平
考虑到星形胶质细胞在各种神经系统疾病病理中的作用,Langley等人首先选取该类细胞进行了高脂饮食的代谢研究。
研究发现,相比正常喂养(脂肪含量占总饮食量的10%,连续喂养12周)的小鼠,高脂喂养(脂肪含量60%,连续喂养12周)小鼠的全髓组织中NAD+水平显著降低(图4A),星形胶质细胞中的CD38含量显著升高(图4B)。而体外培养表现了与动物水平相一致的结果(图4C-F)。
这些数据表明,高脂饮食可诱导动物神经系统中星形胶质细胞活化,增加CD38含量,继而减少NAD+的水平,证实了先前的研究结果,即CD38在高脂饮食摄入后显著升高。
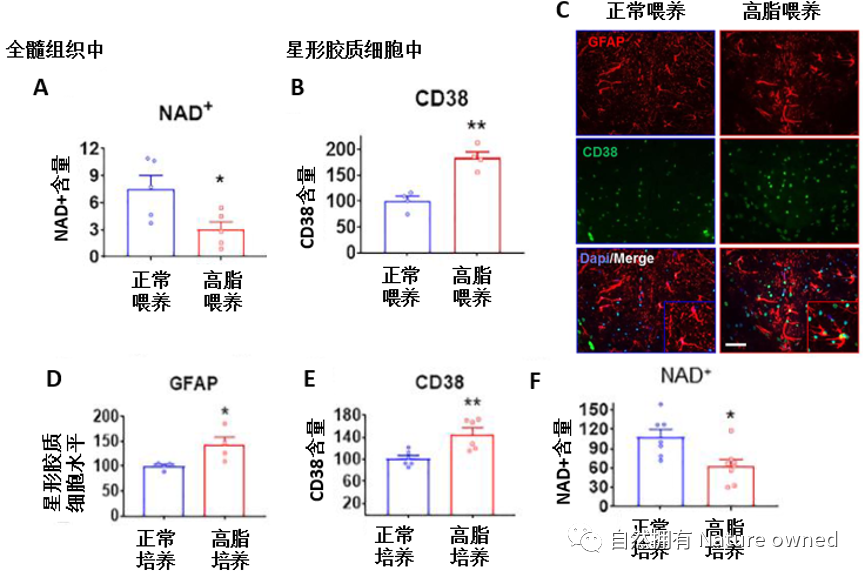
图A为全髓组织中NAD+含量;图B为星形胶质细胞中CD38含量;图C为CD38和星形胶质细胞的免疫荧光图;图D-F为体外高脂培养条件下,星形胶质细胞、CD38和NAD+的变化。其中GFAP是星形胶质细胞活化的标志物。
抑制CD38活性,可抵抗高脂饮食引起的神经细胞减少
由于少突胶质细胞是髓鞘的重要组成部分,而之前的研究[4,5]表明敲除CD38基因可有效抵抗小鼠的脱髓鞘,因此Langley等人继续对其与高脂饮食的关系进行了研究,并着重探究了CD38的作用。
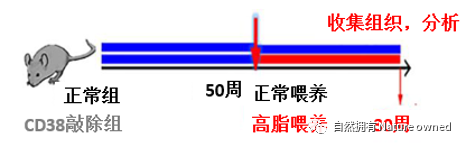
研究将动物分正常小鼠和CD38敲除小鼠。在每种小鼠50周时分别进行正常(10.4%脂肪)和高脂(42%脂肪)喂养,30周后分析四组小鼠的脊髓样本(图5)。
结果显示,与星形胶质细胞结果相似,正常组的高脂喂养小鼠脊髓中CD38水平升高而NAD+水平降低,然而值得注意的是,少突胶质细胞的数量发生显著下降。但当敲除CD38后,发现小鼠可免受高脂诱导的NAD+降低和少突胶质细胞的丢失(图6)。
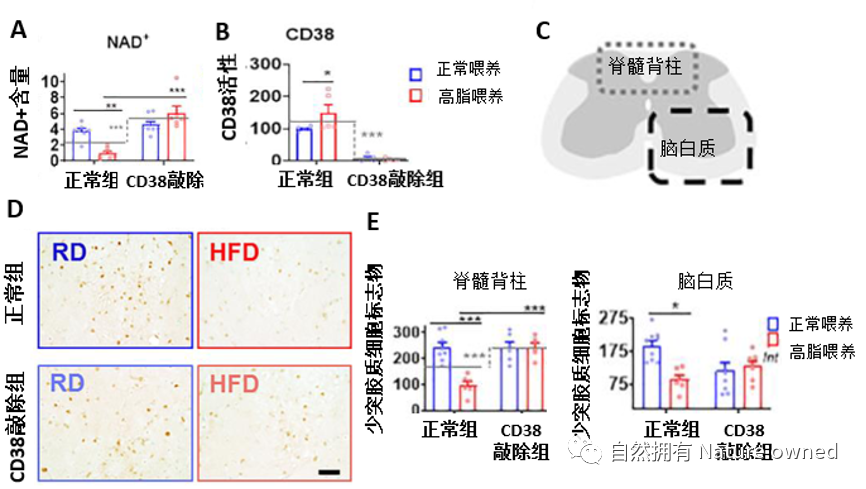
图A和B为高脂饮食对NAD+和CD38活性的影响;图C为脊髓取少突胶质细胞的位置示意图,分为脊髓背柱和脑白质两处;图D为正常组和CD38敲除组小鼠在正常喂养和高脂喂养下少突胶质细胞标志物的免疫染色图;图E为根据免疫染色进行少突胶质细胞的定量分析。
NMN可恢复高脂饮食对神经细胞的损伤,协助髓鞘再生
动物水平尚可实现CD38基因基因敲除,但对于人体尚有难度。因此,Langley等人试图从另一种角度提高NAD+水平来改善高脂对少突胶质细胞的损伤,即使用NAD+前体β-烟酰胺单核苷酸(Nicotinamide mononucleotide,NMN)。
结果显示,相比正常组,高脂显著降低少突胶质细胞的数量和髓鞘蛋白的水平,但联合NMN(100 μM)共培养后,二者可恢复至正常水平,而更为有趣的是,NMN的作用是依赖于一种被称为“长寿因子”的SIRT1蛋白活性,当使用SIRT1抑制剂EX527(5 μM)时,NMN便失去恢复作用(图7)。
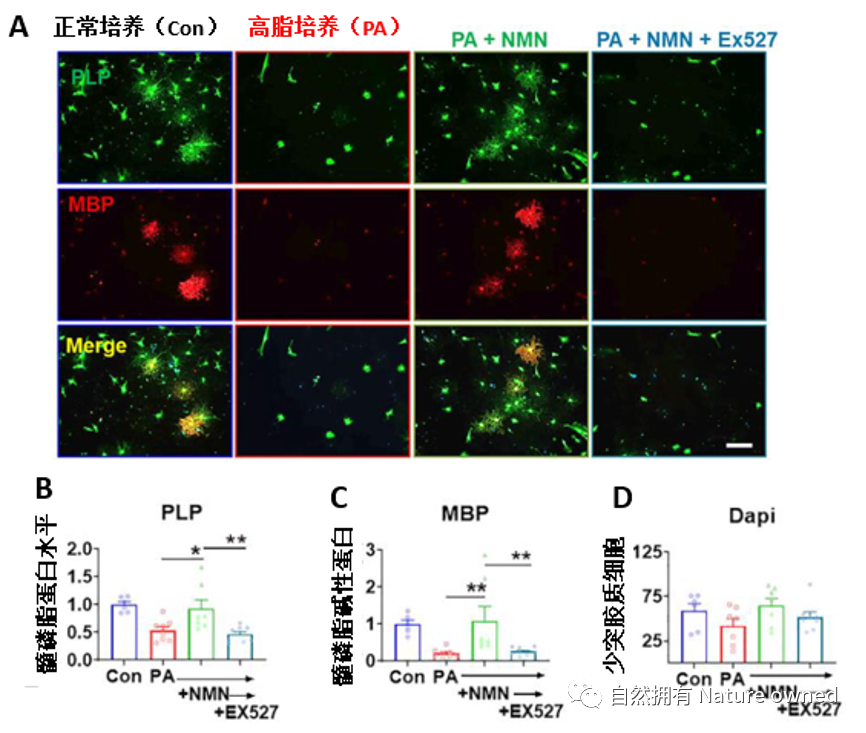
图A为少突胶质细胞的免疫荧光图;图B-C为髓鞘蛋白含量变化图,代表少突胶质细胞的分化能力;图D为少突胶质细胞含量图。其中Con为正常培养组,PA为高脂培养组,PA+NMN为高脂和NMN共培养,PA+NMN+EX527为高脂、NMN和EX527共培养;PLP:髓磷脂髓鞘蛋白、MBP:髓磷脂碱性蛋白,均为髓鞘的主要成分。
静态的星形胶质细胞有助于为少突胶质细胞分化和髓鞘再生提供支持性环境。然而高脂饮食会使静态星形胶质细胞活化,从而增加CD38含量,消耗NAD+水平。而NAD+的下降又会损伤少突胶质细胞的分化和存活。因此,NAD+或许是影响脱髓鞘类疾病发生发展的重要因素之一,而补充NMN或是维持神经细胞NAD+水平、降低高脂对神经细胞损害、提高髓鞘修复能力的潜在方式之一。
Langley等人表示,该研究为未来阐明饮食与神经细胞发育、衰老提供了一定基础,同时也提示着,未来NAD+和CD38靶点或许是改善多发性硬化症等脱髓鞘类疾病的一只“潜力股”。
参考文献
[1] Castro K, Ntranos A, Amatruda M, et al. Body Mass Index in Multiple Sclerosis modulates ceramide-induced DNA methylation and disease course. (2019).EBioMedicine 43:392-410.
[2] Langley MR, Choi CI, Peclat TR, et al. Critical Role of Astrocyte NAD+ Glycohydrolase in Myelin Injury and Regeneration. J Neurosci. 2021 Sep 7:JN-RM-2264-20
[3] Herrmann MM, Barth S, Greve B, Schumann KM, et al. Identification of gene expression patterns crucially involved in experimental autoimmune encephalomyelitis and multiple sclerosis. (2016) .Dis Model Mech 9:1211-1220
[4] Chiang SH, Harrington WW, Luo G, et al. Genetic Ablation of CD38 Protects against Western Diet-Induced Exercise Intolerance and Metabolic Inflexibility. (2015). PLoS One 10:e0134927
[5] Roboon J, Hattori T, Ishii H, et al. Deletion of CD38 Suppresses Glial Activation and Neuroinflammation in a Mouse Model of Demyelination. (2019). Front Cell Neurosci 13:258.
57


